

今天为大家分享的是《颅脑创伤-神经重症病例周刊》特刊,由上海交通大学医学院附属仁济医院吴翔、高国一、冯军峰、毛青、江基尧带来的:颅脑创伤患者颅内压相关参数与预后关系的研究,欢迎阅读、分享。
摘要
目的
探讨颅脑创伤患者的颅内压(ICP)相关参数与预后的关系。
方法
回顾性纳入2016年11月至2017年10月上海交通大学医学院附属仁济医院神经外科重症监护室收治的50例闭合性颅脑创伤患者。患者均行有创颅内压、动脉压监测,采用Neumatic DCR数据采集系统监测ICP相关参数。根据出院时格拉斯哥预后分级(GOS)将患者分为预后不良组(GOSⅠ、Ⅱ级)20例和预后相对良好组(GOSⅢ~Ⅴ级)30例。比较两组患者的ICP相关参数,采用受试者工作特征曲线(ROC)评估相关参数的预测能力。
结果
(1)与预后相对良好组比较,预后不良组的ICP[(26.2±13.4)mmHg对比(14.0±5.6) mmHg]、压力反应指数(PRx,0.48±0.21对比0.12±0.08)及ICP波幅与动脉压波幅的相关系数(IAAC,中位数为0.14对比0.01)均升高,平均脑灌注压[CPP,(48.9±19.9)mmHg对比(81.1±6.9)mmHg]降低,差异均有统计学意义(均P<0.01);ICP波幅与ICP的相关系数(RAP)差异无统计学意义(P>0.05)。多因素二元Logistic回归分析显示,ICP(OR =2.187,95%CI:1.079~4.431,P=0.031)、PRx(OR =21.608,95%CI:3.012~155.014,P=0.002)是预后的独立影响因素。
(2)预后不良组在20 mmHg及22 mmHg阈值上的ICP“剂量”(DICP20、DICP22)均高于预后相对良好组(均P<0.05)。DICP20的ROC曲线下面积为0.70,DICP22为0.71。预后不良组在0.25及0.05阈值上的PRx“剂量”(DPRx0.25、DPRx0.05)均高于预后相对良好组;DPRx0.25的曲线下面积为 0.97,DPRx0.05为0.96。
结论
ICP和PRx为颅脑创伤患者不良预后的独立危险因素;ICP“剂量”和PRx“剂量”均可作为判断患者死亡及植物状态预后的参数,且PRx“剂量”的准确性更高。
持续有创颅内压(intracranial pressure,ICP)监测作为一种能较准确反应颅内压力的方法已被广泛应用于神经外科的患者,特别是重型颅脑创伤患者[1-3]。其可以实现实时ICP的监测,对指导治疗方案和判断预后均有重要的价值。《重型颅脑创伤治疗指南(第四版)》推荐应用ICP监测指导重型TBI的救治,这能够降低住院期间和伤后2周的病死率[4]。
有创ICP监测有多种方式,目前,脑室穿刺ICP探头置入仍是监测ICP的“金标准”[5-6]。有研究显示,除ICP均值外,脑灌注压(cerebral perfusion pressure,CPP)、压力反应指数(pressure reactivity index,PRx)、ICP波幅与ICP的相关系数(regression of amplitude and pressure,RAP)、ICP波幅与动脉压波幅的相关系数(ICP- arterial blood pressure wave amplitude correlation,IAAC)等ICP相关参数可以反应颅内血管状态、颅内代偿空间、脑顺应性等生理指标[7-11],甚至可用以预测颅内病情的恶化和患者的转归[12-14]。
另有研究显示,可以通过ICP在一定阈值之上的曲线下面积,即ICP“剂量”(ICP dose,DICP)来反应继发性颅脑损伤的严重程度[15],该参数预测预后能力较强本研究纳入50例神经外科重症监护室(neurosurgical intensive care unit,NICU)的颅脑创伤患者,通过应用高频率大数据信息采集与分析系统,回[16-17]。顾性研究ICP相关参数与患者预后的关系。
资料与方法
1. 临床资料:回顾性分析2016年11月至2017年10月上海交通大学医学院附属仁济医院NICU收治的闭合性颅脑创伤患者的临床资料。
纳入标准:
(1)因急性闭合性颅脑创伤而急诊入院;
(2)有明确外伤史;
(3)急诊行脑室外引流手术;
(4)术后立即行ICP、有创动脉压等监测。排除存在凝血功能异常,肝、肾功能衰竭等严重基础疾病者。共纳入患者50例,其中男33例,女17例;年龄为30~71岁,平均(53.2±10.3)岁;入院时格拉斯哥昏迷评分(GCS)3~14分,平均(7.9±2.8)分。
2. 数据收集和分组(表1):收集患者的性别、年龄、入院GCS评分等基线资料。患者入院后均急诊行脑室穿刺、ICP探头置入术(ICP监护仪购自法国索菲萨公司或美国强生公司)及桡动脉穿刺术,其中39例同时行去骨瓣减压术。术后均立即连接数据处理工具(Neumatic DCR数据采集系统,上海浩聚公司),按照标准流程,监测并记录多种生理学参数,其中包括有创动脉压、ICP及其相关参数[18] ;均施行规范的神经外科治疗。收集出院时患者的GCS评分和格拉斯哥预后分级(GOS)。根据出院时的GOS将患者分为预后不良组(GOSⅠ、Ⅱ级)20例、预后相对良好组(GOS Ⅲ~Ⅴ级)30例。
表1.两组颅脑创伤患者一般临床资料及颅内压相关参数的比较

注:a为t值,b为χ?值,c为U值;GCS为格拉斯哥昏迷评分,NICU为神经外科重症监护室,ICP为颅内压,CPP为脑灌注压, PRx为压力反应指数,RAP为颅内压波幅与颅内压的相关系数,IAAC为颅内压波幅与动脉压波幅的相关系数;DICP20、DICP22分别是阈值为20mmHg、22mmHg时的DICP;DPRx0.25、DPRx0.05分别是阈值为0.25、0.05时的DPRx
3. ICP监测相关参数的定义和计算:对Neumatic DCR数据采集系统收集的原始数据进行异常值剔除等预处理后,得到ICP、CPP、RAP、PRx、IAAC等各项ICP相关参数。其中,CPP由实时平均动脉压和实时ICP的差值得出;PRx是ICP与动脉压的相关系数(取值范围在-1~1)。DICP的计算:选取开始监测稳定后48h的ICP数据,设置20mmHg(1mmHg=0.133 kPa)、22 mmHg 2个阈值,利用GraphPad Prism 6软件分别计算ICP在这2个阈值基线之上区域的面积,得到该阈值的ICP曲线下面积,定义为该阈值上的DICP(DICP20、DICP22)。PRx“剂量”(PRx dose,DPRx)的计算(图1):选取开始监测稳定后48 h的PRx数据,分别设置0.25、0.05 为阈值,计算该阈值之上的PRx曲线下面积,定义为该阈值上的DPRx(DPRx0.25、DPRx0.05)。
4. 统计学方法:采用SPSS 23.0软件行统计学分析。符合正态分布的计量资料以±s表示,组间比较采用t检验;不符合正态分布的以中位数(M)及
四分位数间距(IQR)表示,组间比较采用Mann-Whitney U检验。计数资料采用频数表示,组间比较采用χ?检验。对单因素分析结果显示可能影响预后的因素行多因素二元Logistic回归分析。利用GraphPad Prism 6软件绘制不同阈值之上的DICP和DPRx的受试者工作特征曲线(receiver operating characteristic curve,ROC),并计算ROC曲线下面积。P<0.05为差异有统计学意义。
结果
1. 影响两组患者预后的单因素分析结果:由表1可见,与预后相对良好组比较,预后不良组患者在监测期间的平均ICP、PRx及IAAC均升高,平均CPP降低,差异均有统计学意义(均P<0.01);而患者的年龄、性别、入院GCS评分、入住NICU时长及RAP,两组差异均无统计学意义(均P>0.05)。
2. 影响患者预后的多因素分析:多因素二元Logistic回归分析显示,两组单因素比较差异有统计学意义的指标(ICP、PRx、IAAC、CPP)中,ICP(OR =2.187,95%CI:1.079~4.431,P =0.031)及PRx(OR =21.608,95%CI:3.012~155.014,P =0.002)是影响患者预后的独立危险因素。
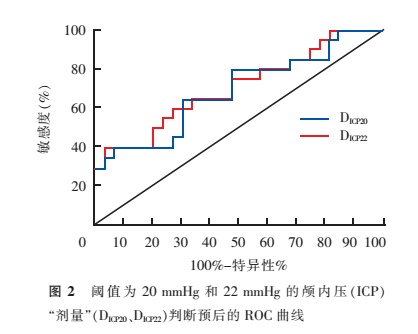
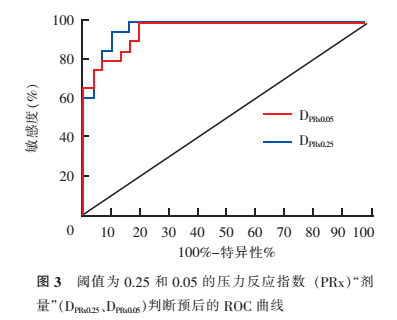
3. 两组患者DICP和DPRx的比较及其对预后预测能力的评估:由表1可见,预后不良组的DICP20、DICP22均高于预后相对良好组(P<0.05);预后不良组的DPRx0.25、DPRx0.25也均高于预后相对良好组(均P<0.001)。ROC曲线显示,DICP20的ROC曲线下面积为0.70(95%CI:0.54~0.85),DICP22为0.71(95%CI:为0.56~0.86)(图2)。DPRx0.25的ROC曲线下面积为 0.97(95%CI:0.93~1.00),DPRx0.05为0.96(95%CI:0.91~1.00)(图3)。
讨论
随着ICP监测技术应用的不断推广,各种ICP相关参数也逐渐受到更多研究者及临床医生的关注。在这些参数中,具体哪些与患者的不良预后相关,以及其对预后判断的准确性,目前的研究尚未给出明确的答案。本研究通过回顾50例颅脑创伤患者的ICP及其相关参数,探究与患者预后相关的参数及其对预后预测的水平。
我们通过单因素分析显示,ICP、CPP、PRx及IAAC在两组间的差异有统计学意义。预后不良组较预后相对良好组的平均ICP更高,CPP更低。这与其他研究的结果相符合,也是目前所倡导的以ICP或CPP为导向的临床治疗的依据[19-20]。目前研究推荐以22 mmHg作为ICP的阈值[12],与我们的研究结果较为统一(预后不良组平均ICP高于此阈值,而预后相对良好组低于此阈值)。
在CPP的目标设立上,有研究推荐60~70 mmHg作为最佳的CPP范围[21],也有研究指出,CPP超过70 mmHg可以改善预后[12,22-23]。在我们的研究中,预后不良组CPP低于此目标范围,这可能与其不良预后有关。单因素分析还发现,预后不良组的PRx、IAAC参数明显高于预后相对良好组。PRx即压力反应指数,是通过计算平均ICP与ABP的相关系数得出,其是反映血管的自主调节能力的参数[24-25];取值范围在-1~1,正值代表ICP与ABP的变化趋势相同,这意味着脑血管床的自主反应性消失,而负值代表着脑血管自主调节能力良好[9]。
目前有研究表明,PRx与患者预后呈现负相关关系,并将0.25及0.05作为阈值,超过此阈值会影响患者的预后[17,24]。与之类似的参数IAAC则是利用相关系数来反映ICP波幅与动脉压波幅的关系。目前,对IAAC的研究较少,但已有的研究指出,IAAC同样可以反映脑血管的自主调节能力,而且与患者的早期预后相关[13]。在本研究中,与预后相对良好组比较,预后不良组的PRx、IAAC显著升高,且PRx升高的幅度高于0.25的阈值水平。
在此基础上,我们纳入了相互独立的、可能影响预后的ICP、PRx及IAAC 3个因素行多因素分析。结果显示,ICP和PRx为影响预后的独立危险因素。这为临床工作中判断患者的病情、选择干预方式及预测预后提供了重要依据。为了进一步研究二者对颅脑创伤患者预后的判断能力,我们对这2个参数进行了进一步分析。
目前现有的研究指出,单纯以平均ICP来判断患者的预后存在如信息不完整、不精确等缺陷[8]。然而,对其进行进一步处理,计算在一定阈值之上的ICP曲线下面积——DICP,可以反应继发性脑损伤的严重程度[15],能较ICP更好地判断患者的预后[16-17]。参考既往DICP研究的阈值设置,我们首先将ICP阈值设置于20mmHg,结果显示,预后不良组的DICP20明显高于预后相对良好组,反映了预后不良组继发性损伤较重,ICP较高且持续时间较长。
由于最新《指南》将ICP阈值由20mmHg提高至22mmHg,我们进一步分析了以22 mmHg为阈值的DICP22,结果同样显示,预后不良组该参数明显高于预后相对良好组。为了判断DICP20、DICP22在判断患者不良预后方面的准确性,我们进行了ROC曲线分析。结果显示,这2个参数均有较高的ROC曲线下面积,其中,DICP22的ROC曲线下面积相对较大。提示DICP20和DICP22对不良预后判断的准确性均较高。具体二者之间的差异有待增加样本量进一步研究。
应用类似的方法,本研究在证实了PRx为影响患者预后的独立危险因素的基础上,为了克服PRx均值的不精确性,在绘制出PRx随时间的变化曲线后,以0.25及0.05为阈值,计算了阈值之上的PRx的曲线下面积,得出了DPRx。我们发现,预后不良组的2个阈值上的DPRx均高于预后相对良好组,这表明预后不良组在较长时间内脑血管反应性均处于较差水平。我们进一步分析了这2个阈值上的DPRx对于患者不良预后的预测能力。结果显示,2个阈值上的DPRx均具有很高的预测准确性,其中,DPRx0.25的面积更大,表明DPRx0.25及DPRx0.05在判断死亡及植物状态预后的能力上均很强,为判断预后较为理想的指标。进一步与2个阈值下的DICP对比,我们发现,DPRx的ROC曲线下面积均高于DICP,这反映了DPRx在判断死亡及植物状态的能力上优于DICP。
综上所述,本研究通过对50例颅脑创伤患者包括ICP、CPP、PRx、RAP及IAAC等ICP相关参数的分析,发现ICP和PRx升高为颅脑创伤患者不良预后的独立危险因素。此外,研究还发现,基于ICP、PRx的DICP、DPRx均可作为判断患者死亡及植物状态预后的参数,且DPRx的准确性更高。作为单中心研究,本研究仍存在如样本量少等不足之处,其结论仍需今后通过多中心、大样本量的研究证实。
参考文献
[1]Hawthorne C, Piper I. Monitoring of intracranial pressure in patients with traumatic brain injury[J]. Front Neurol, 2014,5:121. DOI: 10.3389/fneur.2014.00121.
[2]Cooper DJ, Rosenfeld JV, Murray L, et al. Decompre-ssivecraniectomy in diffuse traumatic brain injury[J]. N Engl J Med, 2011,364(16):1493-1502. DOI: 10.1056/NEJMoa1102077.
[3]Jiang JY. Head trauma in China[J]. Injury, 2013,44(11):1453-1457. DOI: 10.1016/j.injury.2012.08.045.
[4]Farahvar A, Gerber LM, Chiu YL, et al. Increased mortality in patients with severe traumatic brain injury treated without intracranial pressure monitoring[J]. J Neurosurg, 2012,117(4):729-734. DOI: 10.3171/2012.7.JNS111816.
[5]Zhang X, Medow JE, Iskandar BJ, et al. Invasive and noninvasive means of measuring intracranial pressure: a review[J]. Physiol Meas, 2017,38(8):R143-R182. DOI: 10.1088/1361-6579/aa7256.
[6]Bratton SL, Chestnut RM, Ghajar J, et al. Guidelines for the management of severe traumatic brain injury. VII. Intracranial pressure monitoring technology[J]. J Neurotrauma, 2007,24 Suppl1:S45-54. DOI: 10.1089/neu.2007.9989.
[7]Hu X, Xu P, Asgari S, et al. Forecasting ICP elevation based on prescient changes of intracranial pressure waveform morphology[J]. IEEE Trans Biomed Eng, 2010,57(5):1070-1078. DOI: 10.1109/TBME.2009.2037607.
[8]Di IA, Schmitz EM, Cusimano MD. Analysis of intracranial pressure: past, present, and future[J]. Neuroscientist, 2013,19(6):592-603. DOI: 10.1177/1073858412474845.
[9]Czosnyka M, Smielewski P, Timofeev I, et al. Intracranial pressure: more than a number[J]. Neurosurg Focus, 2007,22(5):E10.
[10]Eide PK, Sorteberg W. Association among intracranial com-pliance, intracranial pulse pressure amplitude and intracranial pressure in patients with intracranial bleeds[J]. Neurol Res, 2007,29(8):798-802. DOI: 10.1179/016164107X224132.
[11]Czosnyka M, Pickard JD. Monitoring and interpretation of intracranial pressure[J]. J Neurol Neurosurg Psychiatry, 2004,75(6):813-821.
[12]Sorrentino E, Diedler J, Kasprowicz M, et al. Critical thresholds for cerebrovascular reactivity after traumatic brain injury[J]. Neurocrit Care, 2012,16(2):258-266. DOI: 10.1007/s12028-011-9630-8.
[13]Eide PK, Sorteberg A, Bentsen G, et al. Pressure-derived versus pressure wave amplitude-derived indices of cerebrovascular pressure reactivity in relation to early clinical state and 12-month outcome following aneurysmal subarachnoid hemorrhage[J]. J Neurosurg, 2012,116(5):961-971. DOI: 10.3171/2012.1.JNS111313.
[14]Czosnyka M, Hutchinson PJ, Balestreri M, et al. Monitoring and interpretation of intracranial pressure after head injury[J]. Acta Neurochir Suppl, 2006,96:114-118.
[15]Barton CW, Hemphill JC, Morabito D, et al. A novel method of evaluating the impact of secondary brain insults on functional outcomes in traumatic brain-injured patients[J]. Acad Emerg Med, 2005,12(1):1-6. DOI: 10.1197/j.aem.2004.08.043.
[16]Vik A, Nag T, Fredriksli OA, et al. Relationship of "dose" of intracranial hypertension to outcome in severe traumatic brain injury[J]. J Neurosurg, 2008,109(4):678-684. DOI: 10.3171/JNS/2008/109/10/0678.
[17]Lazaridis C, DeSantis SM, Smielewski P, et al. Patient-specific thresholds of intracranial pressure in severe traumatic brain injury[J]. J Neurosurg, 2014,120(4):893-900. DOI: 10.3171/2014.1.JNS131292.
[18]Wu X, Gao G, Feng J, et al. A Detailed Protocol for Physiological Parameters Acquisition and Analysis in Neurosurgical Critical Patients[J]. J Vis Exp, 2017,(128).DOI: 10.3791/56388.
[19]Karnchanapandh K. Effect of increased ICP and decreased CPP on DND and outcome in ASAH[J]. Acta Neurochir Suppl, 2012,114:339-342. DOI: 10.1007/978-3-7091-0956-4_65.
[20]Carter BG, Butt W, Taylor A. ICP and CPP: excellent predictors of long term outcome in severely brain injured children[J]. Childs Nerv Syst, 2008,24(2):245-251. DOI: 10.1007/s00381-007-0461-z.
[21]Allen BB, Chiu YL, Gerber LM, et al. Age-specific cerebral perfu-sion pressure thresholds and survival in children and adolescents with severe traumatic brain injury*[J]. Pediatr Crit Care Med, 2014,15(1):62-70. DOI: 10.1097/PCC.0b013e3182a556ea.
[22]Huang SJ, Chen YS, Hong WC, et al. Clinical experience of hydroxyethyl starch (10% HES 200/0.5) in cerebral perfusion pressure protocol for severe head injury[J]. Surg Neurol, 2006,66 Suppl 2:S26-31. DOI: 10.1016/j.surneu.2006.07.007.
[23]Lin JW, Tsai JT, Lin CM, et al. Evaluation of optimal cerebral perfusion pressure in severe traumatic brain injury[J]. Acta Neurochir Suppl, 2008,101:131-136.
[24]Czosnyka M, Smielewski P, Kirkpatrick P, et al. Continuous assessment of the cerebral vasomotor reactivity in head injury[J]. Neurosurgery, 1997,41(1):11-17; discussion 17-19.
[25]Lang EW, Chesnut RM. A bedside method for investigating the integrity and critical thresholds of cerebral pressure autoregulation in severe traumatic brain injury patients[J]. Br J Neurosurg, 2000,14(2):117-126.
神外资讯(6.3.16以上版本),找到订阅号中的神外资讯公众号,打开并点击右上角头像,进入神外资讯详细信息页面后,选择置顶公众号,这样您就可以将神外资讯置顶啦!从此,重要信息不再错过哦!
