

来源: CFDA官网
2014年2月7日,国家食品药品监督管理总局发布了《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号),自2014年3月1日起施行。该程序是在确保上市产品安全、有效的前提下,针对创新医疗器械设置的审批通道。
2016年10月26日,国家食品药品监督管理总局发布《关于医疗器械优先审批程序的公告》(2016年第168号),旨在进一步深化医疗器械审评审批改革,保障医疗器械临床使用需求。
“优先审批”和“创新特别审批”同为快速上市通道,可是到底有啥区别?
优先审批VS创新特别审批
一、相同点
其一,“优先审批”和“创新特别审批”同为快速上市通道,对临床急需医疗器械、医疗器械储备品种、儿童或残障人士特有及多发疾病使用的医疗器械品种实施优先开展审评审批的优惠政策,旨在进一步提升医疗器械审评审批能力,保障公众用械安全有效,推动医疗器械产业健康发展。
其二,“优先审批”和“创新特别审批”通过率均很低。其中,创新特别审批的审查通过率不足两成。
二、不同点
(一)优待政策差异
(二)适用范围差异
创新医疗器械特别审批适用范围
食品药品监督管理部门对同时符合下列情形的医疗器械实施创新医疗器械特别审批:
? 有专利——申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
? 有创新——产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
? 有产品——申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
医疗器械优先审批适用范围
国家食品药品监督管理总局对符合下列条件之一的境内第三类和进口第二类、第三类医疗器械注册申请实施优先审批:
1、符合下列情形之一的医疗器械:
(1)诊断或者治疗罕见病,且具有明显临床优势;
(2)诊断或者治疗恶性肿瘤,且具有明显临床优势;
(3)诊断或者治疗老年人特有和多发疾病,且目前尚无有效诊断或者治疗手段;
(4)专用于儿童,且具有明显临床优势;
(5)临床急需,且在我国尚无同品种产品获准注册的医疗器械。
2、列入国家科技重大专项或者国家重点研发计划的医疗器械。
3、其他应当优先审批的医疗器械。
(三)申报流程差异
创新医疗器械特别审批流程
创新特别审批是申请人已完成产品的前期动物研究并具有基本定型产品即可申报。而优先审评是申报人完成临床试验与注册资料准备后,需与首次注册合并申请。
创新特别审批
一、申报失败主要原因
? 专利问题:专利文件不全、专利人和专利内容与项目不符或不是核心技术 ;
? 缺乏显著临床价值的支持性资料;
? 不属于国内首创;
? 不属于国际技术领先;
? 产品未定型;
? 查新报告不合格等
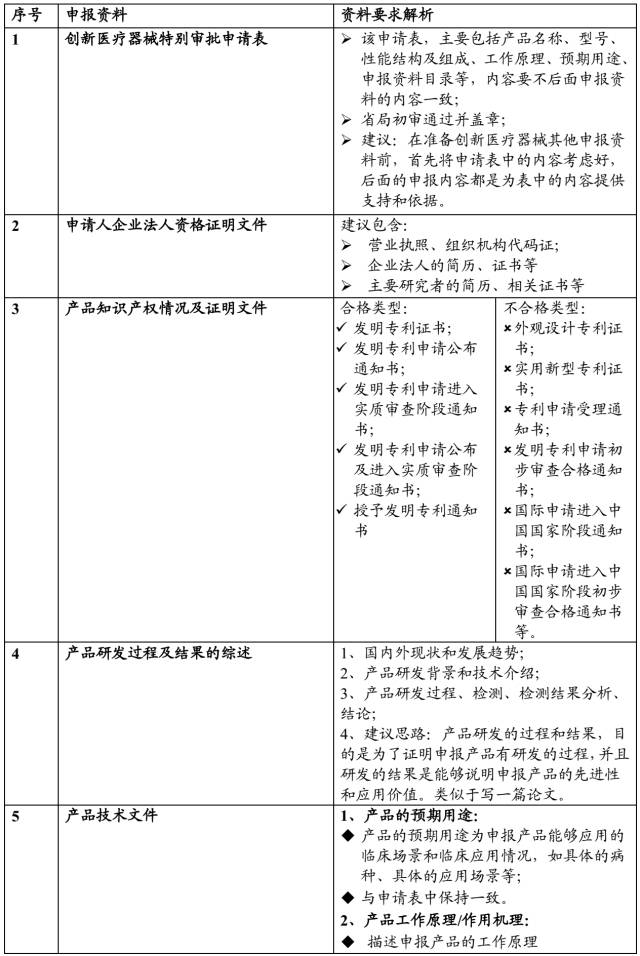
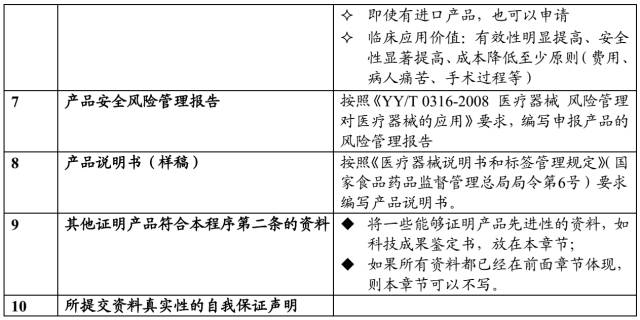
二、申报资料要点

【免责声明】:medworld刊载上述内容,对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。如果您认为我们的授权或者来源标注与事实不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注。
